Interprétation microscopique
Fondamental :
Les molécules d'un corps pur liquide s'attirent mutuellement grâce à l'action des forces de Van der Waals.
L'attraction entre les molécules se compense à l'intérieur du liquide.
Par contre, les molécules qui sont à la surface ne peuvent interagir qu'avec leurs voisines latérales et inférieures. Ainsi, à la surface, les forces de cohésion ne s'équilibrent pas symétriquement comme à l'intérieur du liquide.
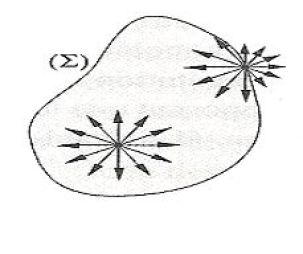
La tension superficielle est la manifestation de cette dissymétrie.
La forme de la surface du liquide sera le résultat de l'équilibre entre la pression du gaz au dessus du liquide, l'attraction par l'intérieur du liquide et le poids.
L'énergie de cohésion par molécule d'un liquide tel que l'huile est de l'ordre de \(k_BT\), où \(k_B\) désigne la constante de Boltzmann et \(T\) la température absolue exprimée en kelvin.
L'ordre de grandeur de l'énergie perdue par une molécule à la surface du liquide sera \(k_BT/2\).
Pour obtenir l'énergie par unité de surface, il suffit de la diviser par la surface de la molécule dont la dimension typique est \(a\approx 5.10^{-10}\;m\):
\(\gamma \approx \frac {k_BT}{2 a^2}\)
Ce qui donne un coefficient de l'ordre de :
\(\gamma \approx 10\;mJ.m^{-2}\)
Et nous verrons, à l'aide de quelques illustrations, que cette valeur est correcte.
Une boucle de fil est attachée en deux endroits à un cadre par deux fils.
On plonge l'ensemble dans de l'eau savonneuse puis on le retire. Il se forme alors une membrane liquide plane qui s'appuie sur le cadre.
Si on crève la membrane liquide dans la boucle uniquement, celle – ci se tend suivant un cercle : la boucle est soumise à des forces de tension superficielle de la part du liquide.
Ces forces sont perpendiculaires en chaque point du contour et tendent à minimiser la surface du film d'eau savonneuse.
Ces forces sont tangentes à l'interface eau – air et réparties de façon uniforme.
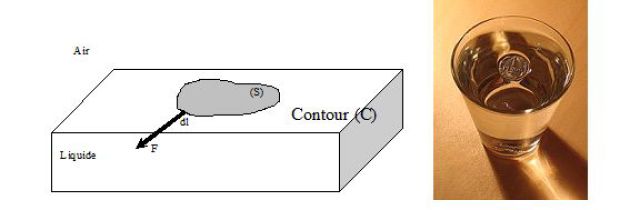
Isolons par la pensée une surface \((S)\) située à l'interface entre un liquide et l'air.
Soit un élément de longueur \(d\ell\) du contour \((C)\) de la surface.
Tout se passe comme si le reste du liquide exerçait sur l'élément de longueur \(d\ell\) une force \(dF\) qui lui est perpendiculaire, dirigée vers l'extérieur de \((S)\) et proportionnelle à sa longueur :
\(dF=\gamma d\ell\)
Ce phénomène tend la surface.
\(\gamma\) est le coefficient de tension superficielle : c'est une force par unité de longueur, exprimé en \(N.m^{-1}\).
Prenons le cas de l'eau :
Sa forte cohésion, due à l'existence de liaisons hydrogènes, permet d'expliquer le fait que des insectes, ou des objets légers comme des trombones peuvent être posés sur la surface de l'eau sans qu'ils coulent ou que l'on puisse verser de l'eau dans un verre, jusqu'à ce que le niveau de l'eau dépasse les bords du verre, sans pour autant qu'elle ne coule.